Главная / Продукция / Каталог статей / Місце антилейкотриєнових препаратів в лікуванні бронхіальної астми у дітей (Статья на языке оригинала)
Алергічні захворювання залишаються однією з актуальних медико-соціальних проблем сьогодення (Антипкін Ю.Г., Лапшин В.Ф., 2011; Хаїтов Р.М., 2011; Jeffrey L.M., 2011). Різноманітні прояви алергічних реакцій і захворювань згідно з даними ВООЗ реєструються у 7-20% населення, причому в останні роки постійно утримується тенденція до їх зростання. Бронхіальна астма є одним із найбільш поширених хронічних гетерогенних захворювань, яке характеризується складними та різноманітними його фенотипічними проявами. Саме тому її відносять до «хвороб цивілізації».
Не випадково алергічні хвороби, які вийшли на перше місце в структурі захворюваності світу, зайняли провідне місце серед причин смертності, інвалідності і тимчасової непрацездатності як дорослого так і дитячого населення. Сучасні наукові напрацювання в дитячій алергології та імунології дозволили отримати вагому інформацію стосовно генетичних передумов реалізації атопії, патогенетичних механізмів формування хронічного запалення, сенсибілізації, що, в свою чергу, сприяло розробці ефективних методів лікування бронхіальної астми.
У патогенезі астми центральне місце займають запалення дихальних шляхів і гіперреактивність бронхів. Порушення бронхіальної прохідності характеризується звуженням просвіту та спазмом гладкої мускулатури бронхів, підвищеною продукцією слизу, набряком слизової оболонки, ушкодженням її епітелію і запальною інфільтрацією, що веде до зворотної обструкції бронхів і бронхіальної гіперреактивності [5].
Визначальну роль у розвитку даного захворювання відіграють IgE-опосередковані алергічні реакції, які характеризуються змінами структурно-функціональних властивостей біомембран відповідальних за алергічне запалення клітин (опасистих клітин, базофілів, нейтрофілів, еозинофілів, Т-лімфоцитів, тромбоцитів), активацією синтезу і секрецією медіаторів алергічних реакцій. В останні роки отримано великий досвід щодо участі медіаторів ліпідного походження, зокрема доведено визначну роль у цьому процесі продуктів метаболізму арахідонової кислоти [8, 13]. Літературні дані свідчать про те, що при бронхіальній астмі має місце активація синтезу ендогенних ейкозаноїдів, представниками яких є лейкотрієни (ЛТ). Найбільша кількість ЛТ синтезуються опасистими клітинами, базофілами, еозинофілами і макрофагами. Цістеїнвмісні лейкотрієни (цЛТ) – ЛТС4, ЛТД4 і ЛТЕ4 утворюються з арахідонової кислоти, яка знаходиться в мембранах клітин, за участю ферменту 5-ліпоксигенази та білка, який його активує (FLAP) (рис. 1). Механізм дії ЛТ пов`язаний із впливом на специфічні рецептори. Існує два типи рецепторів: один – переважно чутливий до ЛТС4 та ЛТД4 і менш чутливий до ЛТЕ4, виявлений в бронхах людини і названий першим типом рецепторів цЛТ. Другий тип лейкотріенових рецепторів знайдений в легеневих венах людини.
Перші дані на підтримку участі цЛТ в патогенезі бронхіальної астми були отримані в дослідженнях, які виявили вивільнення цих речовин після антигенного впливу на легені людини [2, 11]. Крім того, у хворих на бронхіальну астму після антигенної стимуляції в порівнянні із здоровими було виявлено підвищення рівнів цЛТ в біологічних рідинах, у тому числі в бронхоальвеолярному лаважі та сечі. У подальшому було встановлено, що цЛТ викликають бронхоспазм, набряк тканин, секрецію слизу, проліферацію фібробластів, епітелію бронхів і клітин гладкої мускулатури. Доведено, що бронхоконстрикція, що викликається цЛТ, в 1000 разів сильніша, ніж при дії гістаміну.
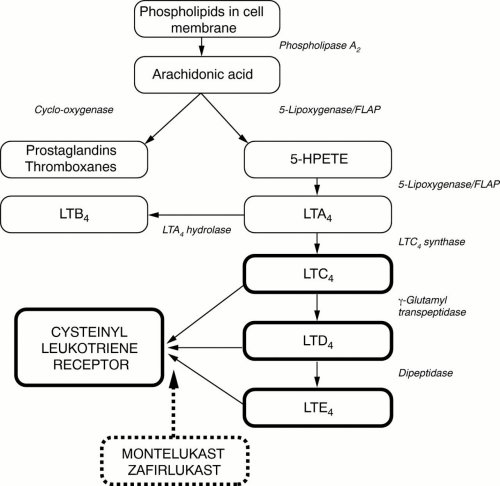
Рисунок 1.
SEDICO Pharmaceuticals Company, 2004
Пошук фармакологічних препаратів антілейкотрієнової дії було розпочато з кінця 70-х років минулого сторіччя. З моменту виявлення перших активних антилейкотрієнових сполук робилися спроби змінити їх структуру, збільшити активність, біосумісність і селективність [9, 11].
У зв`язку з важливою роллю лейкотрієнів у патогенезі бронхіальної астми з середини 1980-х років розпочато вивчення можливості використання в лікуванні бронхіальної астми хімічних сполук антилейкотрієнової спрямованості. Одні з них (Tomelukast, Pobilukast edamine, Verlukast, Zafirlukast (аколат), Pranlukast, Montelukast) є антагоністами лейкотрієнових рецепторів, інші (Zileuton) гальмують синтез лейкотрієнів через інгібування 5-ліпоксигенази або білка активуючого 5-ліпоксигеназу (FLAP) .
На сьогоднішній день препарати антилейкотрієнового дії представлені 4 групами:

- інгібітори 5-ліпоксигенази (зілеутон);
- інгібітори FLAP (MK-886);
- антагоністи рецепторів цЛТ або блокатори рецепторів цЛТ 1 типу (зафірлукаст, монтелукаст, пранлукаст);
- антагоністи рецепторів ЛТВ4.
На українському фармацевтичному ринку зареєстровані лише препарати монтелукасту.
Клінічні дослідження, які вивчали ефективність монтелукасту свідчать про те, що позитивний клінічний ефект спостерігається вже протягом першого дня прийому [3, 6, 10]. У пацієнтів з бронхіальною обструкцією одноразова доза монтелукасту викликає достовірне збільшення об`єму форсованого видиху через 1 секунду (ОФВ1) через годину після прийому препарату незалежно від паралельного використання інгаляційних кортикостероїдів [6, 12]. Монтелукаст натрію ефективний у пацієнтів як в якості монотерапії, так і у випадку комбінації з інгаляційними кортикостероїдами: препарат забезпечує контроль за симптомами астми, зменшує частоту нападів утрудненого дихання, нічні пробудження, використання β2-агоністів [1, 4]. При одночасному застосуванні монтелукасту та інгаляційних кортикостероїдів можливе істотне зниження дози кортикостероїдів. При бронхіальній астмі легкого ступеня тяжкості монтелукаст натрію ефективно запобігає розвитку бронхоспазму, що спричинений фізичним навантаженням [11, 12].
Діюче керівництво «Глобальна ініціатива з бронхіальної астми»(GINA), звіт про лікування астми у дітей «PRACTALL» (Practising Allergology), Британська настанова (British Guideline on the Management of Asthma) та рекомендації ARIA (Allergic Rhinitis and its Impact in Asthma) вказують, що за допомогою антилейкотрієнових препаратів можна ефективно контролювати перебіг захворювання. Схема вибору лікарського засобу для тривалого лікування БА залежить від віку та рівня контролю за перебігом захворювання.
Метою нашого дослідження стало вивчення ефективності та безпечності застосування вітчизняного препарату Монтел (монтелукаст) в комплексному лікуванні бронхіальної астми у дітей.
Під спостереженням знаходилось 18 дітей 6 – 12 років з діагнозом персистуюча бронхіальна астма, які отримували антилейкотриєновий препарат у комплексі з інгаляційним кортикостероїдом та 10 відповідних за віком пацієнтів, які вдихали інгаляційний глюкокортикостероїд (ГКС) в якості монотерапії. Призначаючи базисну терапію ми керувались вітчизняним протоколом діагностики та лікування дітей з бронхіальною астмою № 767 від 27 грудня 2005 року, а також Британським керівництвом ведення хворих з бронхіальною астмою (2009 р.).
Алгоритм ступеневого підходу до лікування БА у дітей віком 5-12 років
(British Guideline on the Management of Asthma, 2009)
Лікування пацієнта слід розпочинати зі ступеня, який найбільше відповідає початковій тяжкості перебігу БА. Перевірте прихильність хворого до терапії та достовірність діагнозу, якщо відповідь на лікування виявилась неочікувано поганою.
СТУПІНЬ 1. Легка інтермітуюча БА
Інгаляційний β2-агоніст короткої дії за потребою.
СТУПІНЬ 2. Регулярна превентивна терапія
Додайте інгаляційний ГКС 200-400 мкг/добу* (чи інший препарат, якщо ГКС не може бути використаний). 200 мкг є доречною початковою дозою для багатьох пацієнтів.
Розпочніть лікування ГКС з дози, відповідної до тяжкості БА. СТУПІНЬ 3. Початок додаткової терапії
- Додайте інгаляційний β2-агоніст пролонгованої дії.
- Оцініть контроль БА:
- гарна відповідь на терапію інгаляційним β2-агоністом пролонгованої дії – продовжте лікування;
- позитивний вплив інгаляційного β2-агоніста пролонгованої дії, але контроль БА все ще недостатній – продовжте терапію згаданим препаратом та підвищте дозу інгаляційного ГКС до 400 мкг/добу* (якщо попередня доза була меншою);
- відсутність відповіді на лікування інгаляційним β2-агоністом пролонгованої дії – відмініть цей препарат і підвищте дозу інгаляційного ГКС до 400 мкг/добу*. Якщо контроль залишається недостатнім, слід провести пробну терапію із застосуванням інших препаратів, наприклад, модифікатора лейкотрієнів або теофіліну пролонгованої дії.
СТУПІНЬ 4. Постійний поганий контроль БА
Підвищте дозу інгаляційного ГКС до 800 мкг/добу*.
СТУПІНЬ 5. Постійний або частий прийом пероральних ГКС
Призначте щоденний прийом перорального ГКС у найнижчій дозі, за якої буде можливим досягнення адекватного контролю.
Продовжуйте лікування інгаляційним ГКС у дозі 800 мкг/добу*.
Направте пацієнта до дитячого пульмонолога.
*Беклометазону або його еквівалента
Монтел призначали по 5 мг (жувальна таблетка) 1 раз на добу ввечері. У разі необхідності, при появі симптомів астми використовували інгаляційні β2-агоністи короткої дії. Тривалість терапії коливалася від 3 до 6 місяців.
Ефективність лікування оцінювалася на основі клінічного спостереження за хворим, опитувальника якості життя зі стандартизованими видами діяльностей для дітей хворих на бронхіальну астму (PAQLQ(S)), спірометрії та пікфлоуметрії.
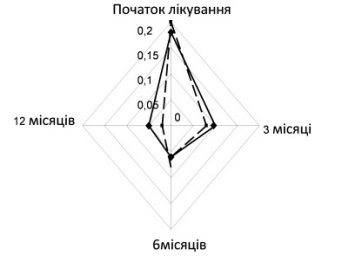
Моніторинг стану пацієнтів здійснювався на третьому та шостому місяці лікування, а також після його закінчення через 6 місяців. Ефективність комбінованої базисної терапії в рамках синергічної взаємодії підтверджується позитивною динамікою клінічних показників та необхідністью у застосуванні екстреної бронхолітичної терапії (рис. 2, 3).
 |
 |
| ― монтелукаст + інгаляційний ГКС; | ----- інгаляційний ГКС |
| Рисунок 2. Динаміка клінічного індексу |
Рисунок 3.Необхідність у β2-агоністах короткої дії |
На початку лікування клінічний індекс, який включав оцінку денних та нічних симптомів, у дітей обох груп був майже однаковим (рис.2). Через 3 місяці від початку базисної терапії максимально виражений позитивний клінічний ефект отримали діти першої групи, яким призначали монтелукаст у комбінації з інгаляційним ГКС (р<0,01). По мірі продовження терміну лікування, через 6 місяців, ефективність застосованих методів терапії зрівнялася і достовірної різниці між групами спостереження виявлено не було. Проте після закінчення курсу базисної терапії, на перший план по клінічному індексу вийшла група дітей, які отримували комбіновану терапію з антилейкотрієновим препаратом (р<0,001). Оцінюючи необхідність у використанні бронхолітичної терапії (рис. 3), слід зауважити, що найбільш ефективною виявилася схема інгаляційний ГКС плюс Монтел, тобто менший відсоток дітей першої групи потребував необхідності у застосуванні препаратів екстреної допомоги (р<0,01).
Паралельно із зазначеною позитивною клінічною динамікою (поліпшення самопочуття хворих, зниження частоти нападів астми, припинення нічного кашлю, більш легкий перебіг загострень) у пацієнтів, що знаходились на комбінованій терапії спостерігалось покращення показників ОФВ1 та пікової швидкості видиху (ПШВ). За даними дослідження функції зовнішнього дихання через 3 тижні від початку терапії у 88,9% хворих спостерігалась нормалізація не лише ОФВ1, але й максимальних об`ємних швидкостей видиху.
У 22 дітей обох груп дослідження протягом усього періоду спостереження здійснювався моніторинг ПШВ за допомогою індивідуальних пікфлоуметрів. Аналіз результатів моніторування показав, що вже через 3 – 4 дні від початку лікування спостерігався приріст показників ПШВ та зменшення його добових коливань. У даної когорти пацієнтів під впливом терапії Монтелом також відзначалося зниження неспецифічної бронхіальної реактивності, що проявлялося зменшенням частоти нападів у зв`язку з вдиханням холодного повітря, емоційною напругою, фізичним перенавантаженням.
У 15 дітей на фоні симптомів бронхіальної астми спостерігались прояви алергічного риніту у вигляді ринореї, утрудненого носового дихання. Вже на 5-7 день лікування у 10 хворих першої групи (66,7%) було відзначено значне покращення назальної прохідності. Досягнутий при включенні в лікування монтелом позитивний терапевтичний ефект зі сторони симптомів алергічного риніту зберігався протягом всього періоду лікування та в середньому протягом 4-х місяців після його завершення.
Важливо зауважити, що монтел позитивно впливає на якість життя дітей з бронхіальною астмою. Про це свідчать дані опитувальника якості життя зі стандартизованими видами діяльностей для дітей хворих на бронхіальну астму (PAQLQ(S)), який ми застосували у ході дослідження після 1-го, 3-го та 6-го місяця лікування [7]. Опитувальник включає 23 запитання, з них – 10 характеризують симптоми астми (S), 5 – стосуються обмеження активності (А) та 8 – описують емоційну функцію (Е). Для того, щоб отримати достовірні дані, які відповідають власним почуттям дитини, без нав`язування думки батьків, опитування здійснювалось на одинці з пацієнтом. Лікар ставив дитині запитання і читаючи варіанти відповіді, дитина самостійно вибирала одну з семи відповідей, яка на її думку характеризує перебіг бронхіальної астми за останні сім днів. Аналізуючи отримані дані ми з`ясували, що якість життя дітей, які отримували в комплексному лікування монтел збільшилась вдвічі не тільки за рахунок зменшення симптомів астми, але й підвищення фізичної активності та нормалізації емоційної дисфункції.
Характеризуючи переносимість призначеної терапії, слід зазначити, що у ході лікування в чотирьох пацієнтів спостерігалось періодичне першіння в горлі та покашлювання після інгаляції ГКС. Проте не було жодного випадку виникнення побічних негативних явищ у дітей на фоні призначення монтелу. Доречно також зазначити, що жодний пацієнт, який отримував антилейкотриєновий препарат не потребував підвищення дози інгаляційного ГКС, а після закінчення курсу лікування, через 6 місяців, у дев`яти пацієнтів вдалося знизити дозу інгаляційного ГКС при збереженні адекватного контролю за перебігом бронхіальної астми.
Таким чином, антилейкотрієнові препарати (Монтел) знижують клінічні симптоми бронхіальної астми, в тому числі кашель, покращують легеневу функцію шляхом помірної бронхіальної дилятації, пригнічують запалення в слизовій оболонці бронхів і знижують, таким чином, частоту нападів. У комбінації з інгаляційними глюкокортикостероїдами вони дозволяють знизити дозу стероїдів та ефективно контролювати перебіг захворювання у пацієнтів з персистуючим варіантом бронхіальної астми.
Література:
- Bleecker ER, Welch MJ, Weinstein SF, Kalberg C, Johnson M, Edwards L, et al. Low-dose inhaled fluticasone propionate versus oral zafirlukast in the treatment of persistent asthma. J Allergy Clin Immunol 2000; 105:1123–1129.
- Currie G.P., Srivastava P., Dempsey O.J. and Lee D.K.C. Therapeutic modulation of allergic airways disease with leukotriene receptor antagonists. Q J Med 2005; 98:171–182.
- H Kotani, R Kishi, A Mouri, T Sashio, J Shindo, A Shiraki, T Hiramatsu, Influence of leukotriene pathway polymorphisms on clinical responses to montelukast in Japanese patients with asthma. J Asthma. 2010 May ;47 (4):429-33.
- Heise CE, O`Dowd BF, Figueroa DJ, Sawyer N, Nguyen T, Im DS, et al. Characterization of the human cysteinyl leukotriene 2 receptor. J Biol Chem 2000; 275:30531–30536.
- Hui Y, Funk CD. Cysteinyl leukotriene receptors. Biochem Pharmacol 2002;64:1549–1557.
- Ilowite J, Webb R, Friedman B, Kerwin E, Bird SR, Hustad CM, Edelman JM. Addition of montelukast or salmeterol to fluticasone for protection against asthma attacks: a randomized, double-blind, multicenter study. Ann Allergy Asthma Immunol 2004; 92:641–8.
- Juniper EF, Guyatt GH, Feeny DH, Ferrie PJ, Griffith LE, Townsend M. Measuring quality of life in children with asthma. Qual Life Res 1996; 5: 35 -46.
- Leff AR. Regulation of leukotrienes in the management of asthma: biology and clinical therapy. Annu Rev Med 2001; 52:1–14.
- Mastalerz L., Kumik J. Antileukotriene drugs in the treatment of asthma // Polskie Archiwum Medycyny Wewnetrznej. – 2010. – Vol. 120, №3. – P. 103–107.
- Mellor EA, Frank N, Soler D, Hodge MR, Lora JM, Austen KF, et al. Expression of the type 2 receptor for cysteinyl leukotrienes (CysLT2R) by human mast cells: functional distinction from CysLT1R. Proc Natl Acad Sci USA 2003; 100:11589–11593.
- Philip G, Hustad C, Noonan G, Malice MP, Ezekowitz A, Reiss TF et al. Reports of suicidality in clinical trials of montelukast. J Allergy Clin Immunol. 2009 Oct;124(4):691-6.e6.
- Philip G, Hustad CM, Malice MP, Noonan G, Ezekowitz A, Reiss TF et al. Analysis of behavior-related adverse experiences in clinical trials of montelukast. J Allergy Clin Immunol. 2009 Oct;124(4):699-706.e8.
- Pillai SG, Cousens DJ, Barnes AA, Buckley PT, Chiano MN, Hosking LK, et al. A coding polymorphism in the CYSLT2 receptor with reduced affinity to LTD4 is associated with asthma. Pharmacogenetics 2004; 14:627–633.

